一、区域划分明确且独立:整体分为洁净区和非洁净区,且洁净区与非洁净区之间人流通过更衣缓冲系统进入,物流通过传递窗传递 。洁净区包括操作区、制备区、质量控制区、支架材料处理室、组织样本处理室、细胞分离室、细胞培养室、组织构建室、无菌质量检测与控制室等;非洁净区包括组织学检测室、分子生物学检测室、储存室、监控中心、资料档案室等。各功能区域应相对独立,有满足其功能需要的空间、设施、设备和洁净度要求。质量控制区应与制备区实施物理隔离,行政区、生活区及辅助区等应不防碍干细胞制剂的制备。
二、满足特定洁净度要求:按照现行国内 GMP 标准,核心功能区的洁净等级应整体达到 C 级,局部达到百级。制备区、制备区缓冲间、洁净器具等主实验室区域采用 B 级净化环境,其他质控、检测、样本传递等房间采用 C 级净化环境,污物递出、换鞋等次要辅助房间可采用 D 级环境。不同操作对洁净度要求不同,如非完全密封状态下的细胞操作以及与细胞直接接触的无法终端灭菌的试剂和器具的操作,应在 B 级背景下的 A 级环境中进行。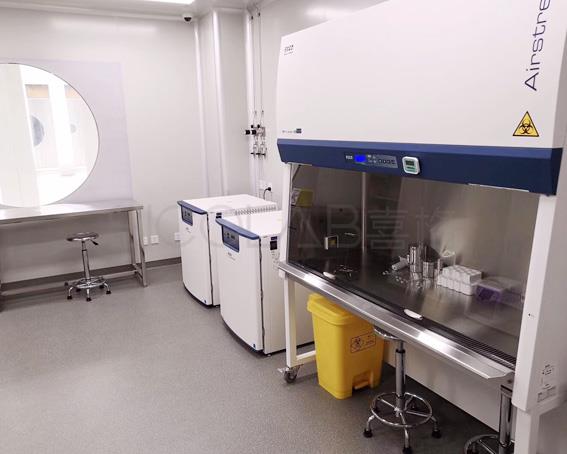
三、遵循特定设计原则:遵循人、物分流,洁、污分流的原则。例如,样本在样本接收间通过传递窗进入实验区后,在样本处理间进行样本前处理;洁净物品在物品接收间拆包后,通过自净传递窗进入实验室洁净库房存放;实验产生的污物收集后需在灭菌室灭活后,通过传递窗传到实验室外污物暂存室暂存处理。实验室人员通过更衣缓冲进入核心实验区,做完实验之后通过退更缓冲退出实验室。若实验室设置阳性细胞制备间,应设置独立退出通道。
四、合理安排操作区域:合理安排制备工序的操作区域,不同质量标准或者工艺规程的干细胞制剂应在不同的房间操作;试剂的准备,干细胞的分离、扩增和诱导分化,干细胞制剂的配制和灌装或分装等操作,应在洁净区内分区域进行;不同批次的干细胞制剂不应同一时间在同一 A 级区域内操作。
SICOLAB喜格是一家专业从事实验室家具生产定制、实验室设计、实验室装修、实验室建设、实验室改造的EPC总包工程企业,18年设计施工经验,服务于1000+客户群体,其中包含不限于科研院校、生物医药、医疗卫生、环保水务、检验检疫、公安系统、石油化工、第三方检测、其他企业等。业务则涵盖于:实验室平面设计、实验室施工图设计、实验室效果图设计、实验室规划建设方案、实验室各系统设计安装施工、实验室装修造价预算、实验室建设咨询、实验室搬迁择址咨询等等。400-8879-829




















